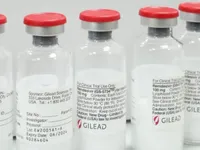
Gilead Sciences (có trụ sở tại thành phố Foster, bang California, Mỹ) cho biết, số thuốc thu hồi thuộc hai lô chỉ giới hạn tại Mỹ, có thể đủ để điều trị cho 11.000 bệnh nhân. Hiện chưa có báo cáo nào ghi nhận phản ứng phụ liên quan số thuốc bị nhiễm bẩn.
Remdesivir dùng cho người lớn và trẻ em trên 12 tuổi, phải điều trị COVID-19 tại bệnh viện. Thuốc được truyền qua đường tĩnh mạch 1 lần/ngày và tối đa trong 10 ngày.
“Gilead Sciences tiếp nhận đơn khiếu nại của khách hàng và kết quả đã được xác nhận thông qua cuộc điều tra do chính công ty thực hiện”, theo thông báo từ hãng dược Mỹ.
Tuy nhiên, nhà sản xuất đưa ra cảnh báo: "Một sản phẩm tiêm chứa hạt thủy tinh có thể gây kích ứng hoặc sưng tấy cục bộ do cơ thể phản ứng trước ngoại vật. Nếu các hạt thủy tinh di chuyển vào mạch máu, chúng có thể tiếp cận nhiều cơ quan nội tạng và gây thuyên tắc mạch máu ở tim, phổi hoặc não, từ đó gây nguy cơ đột quỵ và thậm chí dẫn đến tử vong".

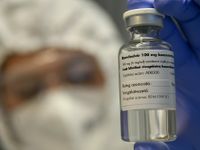
Thuốc điều trị COVID-19 Remdesivir do hãng Gilead Sciences sản xuất. (Ảnh: AP)
Người phát ngôn Chris Ridley của Gilead Sciences cho biết, việc thu hồi không ảnh hưởng nguồn cung Remdesivir vì hãng vẫn còn nhiều thuốc cho phép nhanh chóng bổ sung đơn hàng.
Remdesivir được Cơ quan Quản lý thực phẩm và dược phẩm Mỹ (FDA) phê chuẩn điều trị khẩn cấp từ tháng 5/2020. Đến tháng 10/2020, Remdesivir trở thành liệu pháp điều trị COVID-19 đầu tiên được FDA cấp phép đầy đủ.
Remdesivir cũng là thuốc được phê chuẩn nhiều nhất trên thế giới hiện nay. Tổng cộng khoảng 50 quốc gia và vùng lãnh thổ đã thông qua việc sử dụng loại thuốc này trong điều trị COVID-19. Đến nay, 9 triệu người được điều trị bằng thuốc Remdesivir, trong đó có 6,5 triệu người ở 127 quốc gia thu nhập thấp và trung bình của thế giới.




Bình luận (0)